
La afinidad eléctrica, afinidad electrónica o AE es la energía intercambiada cuando un átomo neutro, gaseoso, y en su estado fundamental, capta un electrón y se convierte en un ión mononegativo
La afinidad electrónica es la cantidad de energía absorbida por un átomo aislado en fase gaseosa para formar un ión con una carga eléctrica de −1. Si la energía no es absorbida, sino liberada en el proceso, la afinidad electrónica tendrá, en consecuencia, valor negativo tal y como sucede para la mayoría de los elementos químicos; en la medida en que la tendencia a adquirir electrones adicionales sea mayor, tanto más negativa será la afinidad electrónica. De este modo, el flúor es el elemento que con mayor facilidad adquiere un electrón adicional, mientras que el mercurio es el que menos.
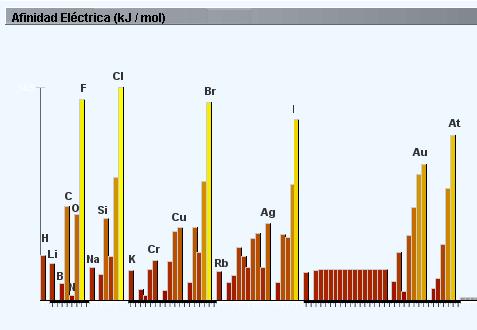
Aunque la afinidad electrica parece variar de forma caótica y desordenada a lo largo de la tabla periódica, se pueden apreciar patrones. Los no metales tienen afinidades electrónicas más bajas que los metales, exceptuando los gases nobles que presentan valores positivos por su estabilidad química, ya que la afinidad electrónica está influenciada por la regla del octeto.
Los elementos del grupo 1, tienden a ganar un electrón y formar aniones −1, completando el subnivel s, mientras que los elementos del grupo 2, que ya lo tienen completo, no presentan esa tendencia. Análogamente sucede en el bloque p, donde las afinidades electrónicas se van haciendo más negativas a medida que nos acercamos a los gases nobles.
Existen átomos que presentan capas de valencia con lugares vacantes o "huecos", que pueden ser ocupados por electrones.
Entonces cuando a un átomo neutro se le añaden uno o más electrones se presenta un desprendimiento de energía, conocida como afinidad electrica, obteniéndose como resultado la formación de aniones.
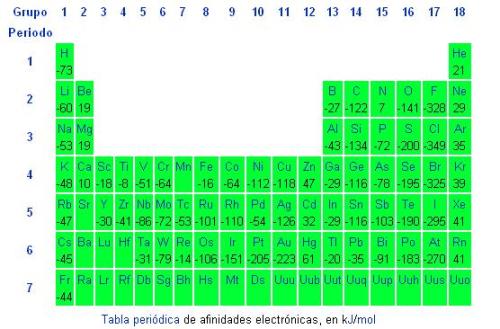
Aunque la magnitud de dicha energía liberada sólo puede determinarse indirectamente y muy rara vez con gran exactitud, en la tabla periódica la podemos predecir en orden ascendente en un mismo período, de izquierda a derecha, y en un mismo grupo, de abajo hacia arriba.
El átomo
En química y física, átomo (del latín atomus, y éste del griego άτομος, indivisible) es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.
El concepto de átomo como bloque básico e indivisible que compone la materia del universo ya fue postulado por la escuela atomista en la Antigua Grecia. Sin embargo, su existencia no quedó demostrada hasta el siglo XIX. Con el desarrollo de la física nuclear en el siglo XX se comprobó que el átomo puede subdividirse en partículas más pequeñas.
La teoría aceptada hoy es que el átomo se compone de un núcleo de carga positiva formado por protones y neutrones, en conjunto conocidos como nucleón, alrededor del cual se encuentra una nube de electrones de carga negativa.
Tabla periódica de los elementos
La tabla periódica de los elementos es la ordenación que, atendiendo a diversos criterios, distribuye los distintos elementos químicos conforme a ciertas características.
Suele atribuirse la tabla a Dimitri Mendeleiev, quien ordenó los elementos basándose en la variación computacional de las propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo una ordenación a partir de las propiedades físicas de los átomos.
Orígenes
Aunque algunos elementos como el oro, plata, estaño, cobre, plomo y Mercurio ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en 1669 cuando el alquimista Henning Brand descubrió el Fósforo.
El descubrimiento de la mayor parte de los elementos se llevó a cabo durante el siglo XIX; en 1830 ya se conocían 55 elementos. Un requisito previo necesario a la construcción de la tabla periódica era el descubrimiento de un número suficiente de elementos individuales, que hiciera posible encontrar alguna pauta en comportamiento químico y sus propiedades. Durante los siguientes 2 siglos, se fue adquiriendo un gran conocimiento sobre estas propiedades, así como descubriendo muchos nuevos elementos.
El concepto actual de elemento químico según la idea expresada por Robert Boyle en su famosa obra "The Sceptical Chymist", "ciertos cuerpos primitivos y simples que no están formados por otros cuerpos, ni unos de otros, y que son los ingredientes de que se componen inmediatamente y en que se resuelven en último término todos los cuerpos perfectamente mixtos", desarrollado posteriormente por Lavoisier en su obra "Tratado elemental de Química", condujo a diferenciar en primer lugar qué sustancias de las conocidas hasta ese momento eran elementos químicos, cuáles eran sus propiedades y cómo aislarlos.
El descubrimiento de un gran número de nuevos elementos, así como el estudio de sus propiedades, pusieron de manifiesto algunas semejanzas entre ellos, lo que aumentó el interés de los químicos por buscar algún tipo de clasificación.
Fuentes: Wikipedia - Academia de Ciencias Galilei